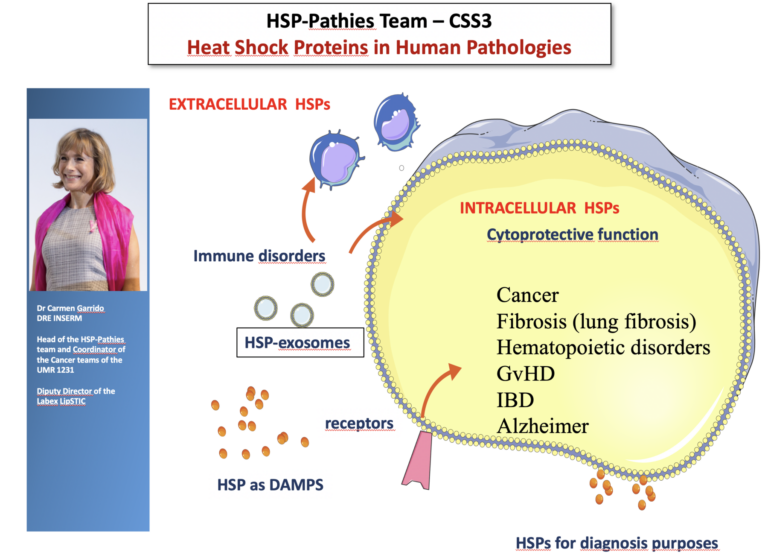
Pathologies humaines associées aux protéines de choc thermique ou HSP
Publications Sélectionnées
- Carmen Garrido (DRCE Inserm) Contact : mail
- Gaetan Jego (PU, HDR) Contact : mail
- Oleg Demidov (CRCN Inserm, HDR) Contact : mail
- Laurence Dubrez (CRHC Inserm, HDR)
- Marc Bardou (PU-PH)
- Alvaro Baeza (Post-Doc)
- Jimena Abrey (post-doc)
- Nicolas Pernet (IR Inserm)
- Flavie Miele (PhD)
- Aude Chavanon (PhD)
Collaborations : A Duval (H Saint Antoine, Paris), C Lepage (CHU Dijon), O Casasnovas (CHU Dijon), AM Cuervo (A Einstein Institute, NY); E Appella (NCI MIH, USA). Financement : I-SITE-BFC. ANR-15-IDE-0003 (2017-2021); Label d’excellence LNCC (2019-2023). INCa PLBIO 2022-26. Prix Ligue contre le Cancer 2021.
Rationnel. Nous avons trouvé une mutation de HSP110 dans 10 à 15 % des cancers colorectaux et gastriques et cette inactivation de HSP110 était associée à un excellent pronostic i.e. réponse à une thérapie à base d’oxaliplatine/5-fluorouracile (étude multicentrique incluant plus de 3000 patients. Dorard et al, Nature Med 2011 ; Collura et al, Gastroenterol 2014). Nous avons démontré que cela pourrait s’expliquer par l’effet de HSP110 favorisant la réparation de l’ADN endommagé et par son rôle immunosuppresseur dans le microenvironnement tumoral (Duvrez et al, Oncogene 2021 ; Causse et al, Oncogene 2020 ; Uyanik et al, Nature Commun 2021).
Objectifs. 1) Étudier le rôle nucléaire de HSP110 dans la réparation de dommages dans l’ADN ; 2) Décrypter le rôle de HSP110 extracellulaire sur les cellules immunosuppressives ; 3) Vérifier chez les patients atteints de cancer colorectal (cohortes PRODIGE. Synopsis disponible sur www.ffcd.fr), si les niveaux circulants (libres ou au sein des exosomes) de HSP110 peuvent être mesurés, peuvent prédire l’expression de HSP110 dans la tumeur et peuvent être utilisés comme marqueurs de réponse à la chimio ou à l’immunothérapie. 4) Mener des études structurales et chimiques afin qu’au moins une de nos molécules, sélectionnées pour leur capacité à inhiber spécifiquement HSP110 (Gozzi et al, Cell Death & Diff 2020 ; Marcion et al, Int J Cancer 2021), puisse être utilisée chez les patients (en association avec des chimiothérapies ou des immunothérapies). La détection de HSP110 circulant peut aider à surveiller l’évolution de la maladie et/ou à sélectionner les patients plus à même de bénéficier de notre thérapie ciblée sur HSP110.
- Jessica Gobbo Contact : mail
- Carmen Garrido (DRCE Inserm) Contact : mail
- Adiilah Mamode-Cassim (Post-Doc)
- Hafidha Bentayeb (Post-Doc)
- Estefania Magalhaes(PhD)
- Valentin Vautrot (Post-Doc)
Collaborations : J Goetz, (Inserm 1109, Strasbourg), C Coutant (CGFL, Dijon), F Aubin (CHU Besançon), F Ghiringhelli (CGFL), L Briand (INRA, Dijon), W Boireau (FEMTO, Besançon), J Matias (CHU San Carlos Madrid) and V Cottet (CIC 1432). Financement : INCa EVRALTIC (2020-2023); INCa PLBIO20-160 (2020-2023); INCa PLBIO21-107 (2021-2024) Prix :Ruban Rose Avenir 2016, Estée Lauder 2016, Odyssea 2017, Fondation Silab Jean Paufique 2019, Grand Prix de Recherche Ruban Rose 2021
Rationnel. Les cellules cancéreuses libèrent des exosomes avec HSP70 dans leur membrane (HSP70-exosomes) alors que les cellules « normales » ne le font pas. Nous avons proposé une méthodologie pour capturer ces exosomes tumorales du sang en utilisant une approche optique (« biolayer interferometry ») et comme ligand de haute affinité un aptamère peptidique appelé A8. Avec cette technologie brevetée, nous avons mesuré les HSP70-exosomes circulants chez les patients atteints de cancer (cohortes EXODIAG et EXOMEL) et avons apporté la preuve de principe que les HSP70-exosomes (associés ou non à PD-L1) peuvent être quantifiés dans des échantillons de plasma et d’urines notamment pour la détection de métastases (Gobbo et al, JNCI 2016 ; Chanteloup et al, JEV 2020 ; Cordonnier et al, JEV 2020). D’un point de vue thérapeutique, nous avons démontré que ces HSP70-exosomes étaient capables d’activer les cellules myéloïdes suppressives et avons sélectionné et breveté une molécule chimique qui, en se liant à cette HSP70 extracellulaire, bloque l’effet immunosuppresseur des exosomes tumoraux (Chalmin et al JCI 2010 ; Hadi et al, JCI Insight 2020).
Objectifs. 1) développer une plateforme de suivi des cancers à partir d’échantillons de sang permettant (i) la quantification des HSP70-exosomes et (ii) l’identification d’autres biomarqueurs exosomales (lipides, mi-ARN, protéines) pouvant être associés à HSP70. 2) Dans nos modèles de cancer précliniques, nous testerons nos inhibiteurs de HSP70 combinés à d’autres thérapies immuno-thérapeutiques : les anticorps PD-L1/PD-1. 3) Les HSP70-exosomes en tant que marqueurs de diagnostic ont un grand intérêt pour de nombreuses maladies. Avec l’unité Inserm de recherche clinique du réseau français de gynécologie et d’obstétrique, nous allons mesurer les HSP70-exosomes dans l’urine de femmes enceintes atteintes de prééclampsie (avant et un an après l’accouchement) pour déterminer si ces exosomes de stress peuvent être utilisés comme marqueurs du risque cardiovasculaire observé chez les femmes prééclamptiques.
Équipe :
- Philippe Bonniaud (PU-PH) Contact : mail
- Françoise Goirand (MCU-PH) Contact : mail
- Olivier Burgy (MCU) Contact : mail
- Pierre-Simon Bellaye (researcher CGFL)
- Guillaume Beltramo (MCU-PH)
- Maximilien Spanjaard (clinicien-PH)
- Julie Tanguy (Post-doc)
- Lucile Dondaine (IE)
- Judith Meyer (IE)
Collaborations : L’équipe fait également partie du Centre Constitutif de Référence des Maladies Pulmonaires Rares, Hôpital Universitaire de Dijon). M Kolb (Hamilton, Canada), B Crestani (Inserm U700 Bichat, Paris), V Cottin (HCL- OrphaLung, Lyon) Andreas Guenther (Giessen, Allemagne) P Rocchi (Inserm 1068, Institut P Calmettes, Marseille), P Barthélémy (INSERM U1212) ; M Königshoff (DenverPittsburgh, USA). Financement : Contrat européen, HEALTH-F2-eurIPFnet ; ANR MESO -IPF (2012-2015), ANR SHOT-IPF (2016-2020) ; ANR-I-SITE-BFC (2019-2022) ; European Joint Programme on Rare Diseases ; RARE-ILD ; European FP7 eurILDFreg ; ANR- AAPG-2021-Smart Progress (2021-2025).
Rationnel. Les maladies fibroprolifératives peuvent affecter tous les tissus et organes et sont responsables de 45 % des décès dans le monde. Parmi elles, les fibroses pulmonaires progressives avec différentes maladies dont la fibrose pulmonaire idiopathique (FPI) constituent un problème clinique majeur. Malgré l’apparente hétérogénéité des maladies fibrosantes progressives, un dénominateur commun est le rôle clef du Transforming Growth Factor (TGF)-β1, importante cytokine pro-fibrosante. A l’exception de la pirfénidone et du nintédanib qui retardent le déclin de la fonction respiratoire, aucun autre traitement n’est actuellement disponible. Il est urgent de proposer de nouvelles cibles thérapeutiques/médicaments efficaces contre la fibrose. Nous avons précédemment démontré que HSP27 (HSPB1) et alpha-B-cristallin (HSPB5) étaient surexprimées dans les poumons des patients atteints de FPI et démontré dans des modèles expérimentaux qu’elles favorisaient la fibrose en stabilisant des protéines clés de la voie de signalisation pro-fibrosante du TGF-β1 (Smad4, Snail) (Burgy et al, Science Transl Med 2016 ; Bonniaud et al, Eur Resp J 2018 ; Boutanquoi et al Eur Resp J 2020). La recherche translationnelle se fait en lien avec le Centre Constitutif de Référence pour les maladies pulmonaires rares, CHU- Dijon.
Objectifs. 1) étudier les interactions HSPB1/Snail et HSPB5/Smad4 pour identifier les domaines cibles. 2) Cribler des inhibiteurs spécifiques de HSP (molécules chimiques, oligonucléotides antisens, ASO) capables de bloquer les voies pro-fibrosante du TGF-β1. 3) Les tester dans nos modèles précliniques, seuls ou en combinaison avec la pirfénidone et le nintédanib. 4) Comprendre le rôle des HSP extracellulaires dans la phase inflammatoire précoce qui précède le processus fibrotique. 5) Explorer la possibilité d’utiliser les HSP circulantes (libres ou dans les exosomes) comme marqueurs précoces de la fibrose et/ou pour prédire la réponse aux thérapies. 6) Développer des biomarqueurs compagnons des anti-HSPB1, -HSPB5 en utilisant nos ASO (objectif 2) radiomarqués au Gallium-68 ; l’équipe a déjà une expertise (avec Inserm Transfert). Nos molécules visant à interférer avec la fibrogénèse peuvent représenter des pistes pharmacologiques pour traiter non seulement la fibrose pulmonaire mais aussi la fibrose rénale (avec K El Karoui, Hôpital Mondor, Paris) et la myélofibrose (voir ci-dessous).
B HSP27 dans les néoplasmes in myéloprolifératives et la myélofibroseÉquipe :
- François Girodon (PU-PH)(PU-PH) Contact : mail
- Gaëtan Jego (PU)
- Romain Mary (Post doc)
- Mathilde Regimbeau (Doc)
- Manon Durand (Doc)
Collaborations : Olivier Hermine (Inserm 1163, Institut Imagine, Paris), I Plo (INSERM UMR U1170, IGR, Villejuif); Financement : ANR PRTS (2016-2021), Association “Laurette Fugain” and Labex GR-Ex.
Rationnel. Nous avons démontré que HSP27 était un nouvel acteur dans les néoplasmes myéloprolifératifs (MPN) grâce à son effet facilitant l’assemblage JAK2/STAT5. En utilisant un ASO spécifique de HSP27 dans 2 modèles animaux de myélofibrose, nous avons observé une diminution de la progression de la myélofibrose, associée à une diminution marquée du nombre de plaquettes ainsi que des mégacaryocytes (Sevin et al, Nature Commun 2018).
Objectifs. 1) Explorer le rôle de HSP27 dans la mégacaryopoïèse normale, dans la polyglobulie primitive (PV) et la thrombocytémie essentielle (ET) ; 2) Évaluer l’impact de nos inhibiteurs de HSP27 (ASO et composés chimiques) in vivo dans deux modèles murins (JAK2V617F et CALRdel52) ; 3) Étudier l’interaction entre HSP27 et calréticuline (CALR) et les consequences de cette association ; 4) Mesurer les niveaux de HSP27 dans les échantillons humains PV et ET(sérum, les cellules progénitrices hématopoïétiques circulantes CD34+ et biopsies de moelle osseuse) ; 5) Évaluer l’impact pronostique de HSP27 chez les patients MPN (cohortes CHU Dijon et IGR, Vilejuif).
A HSP90 et HSP70 dans les leucémies Aiguës Lymphoblastiques (LAL)
Équipe :
- Ronan Quéré (CRCN Inserm, HDR) Contact : mail
- Aleksandra Georgievski (PhD)
Collaborations : Paola Ballerini (AP-HP, Paris), Pierre-Simon Bellaye (CGFL, Dijon), Jean-Paul Pais de Barros (UB). Financement : Ligue régionale contre le Cancer, Société Française de Lutte contre les Cancers et Leucémies de l’Enfant et de l’Adolescent (SFCE), Association pour la Recherche sur le Cancer (ARC), Hôpital Universitaire de Dijon (AAP Collection 2020).
Rationnel. : Les inhibiteurs d’HSP90 et d’HSP70 n’ont pas encore été explorés chez les patients atteints par une LAL. Nous avons découvert qu’) HSP90 et HSP70 étaient fortement exprimés par les cellules LAL (Mshaik R, et al. Blood Cancer J. 2021, Georgievski A, et al. Cell Death Dis. 2022). Les cellules LAL produisent des Vésicules Extracellulaires (VE) qui expriment HSP70 et qui ont un impact dans le microenvironnement de la moelle osseuse (Georgievski A, et al. Cell Death Dis. 2022) et notamment sur l’hématopoïèse normale (Hermetet et al. Nature Commun, 2019).
Objectifs. Grâce à l’utilisation de la xénotransplantation de cellules humaines isolées de patients atteints par une LAL (modèles PDX), nous développons des études précliniques afin d’étudier 1) si l’utilisation des inhibiteurs d’HSP90 et HSP70 est efficace ; 2) leur mécanisme d’action moléculaire ; 3) le rôle des VE produites par les cellules LAL dans le développement du cancer. 4) la purification de ces VE dans le sang des patients afin de développer un outil sensible pour la détection des rechutes thérapeutiques (coll. Paola Ballerini, AP-HP).
B HSP90 extracellulaire comme nouveau marqueur et cible thérapeutique dans la fibrose pulmonaire induite par l’hypoxie
Équipe :
- Pierre-Simon Bellaye (Chercheur CGFL/Pham’Image) Contact : mail
- A Dias (Chercheur CGFL)
- M Guillemin (Technicienne CGFL)
- O Burgy (MCU)
- P Bonniaud (PU-PH)
- J Tanguy (PhD)
Collaborations : A Cochet (PU-PH CGFL). F Denat, C Bernhard and M Moreau (ICMUB Dijon). Financement : ANR HYMAGE-IPF.
Rationnel. Nous avons démontré que, dans des conditions de fibrose, les cellules épithéliales du poumon sécrètent la protéine HSP90 qui interagit avec la protéine LRP1 (low-density lipoprotein Receptor-related Protein-1) exprimée par les fibroblastes environnants pour promouvoir les voies de signalisation profibrotiques. (Bellaye et al, Eur Resp J, 2018; Tanguy et al, Int J Mol Sci 2021; Bonniaud et al, Eur Resp J 2018).
Objectifs. Développer un agent théranostique basé sur des fragments Fab d’un anticorps anti-HSP90 (MC5) radiomarqué à l’indium-111. Il a été démontré que cet anticorps (4C5) cible exclusivement HSP90 extracellulaire. Le Fab anti-HSP90 sera bioconjugué avec un agent chélatant capable de “piéger” le radionucléide pour l’imagerie SPECT. L’effet antifibrotique de ce Fab anti-HSP90 sera également testé in vitro et in vivo dans nos modèles de fibrose pulmonaire.
C. GRP94: rôle dans la polarisation des macrophages à l’état basal et en situation de stress du RE; intérêt comme cible thérapeutique
Équipe :
- Evelyne Kohli (PU-PH). Contact : mail
- Valentin Baverel (PhD)
- Alexanne Bouchard (PhD)
- Fangmin Wang (PhD)
Collaborations : B Collin (Pharm’Image, CGFL Dijon); M Narce (UMR INSERM/uB/AGROSUP 1231 Dijon); W Zhou (Ningbo University,China). Financement : Label LNCC; ANR-10-EQPX-05-01.
Rationnel. GRP94 (Glucose-regulated glycoprotein 94) est un membre de la famille des HSP90 du réticulum endoplasmique (RE) exprimé de manière constitutive dans toutes les cellules et augmenté en cas de stress du RE. GRP94 joue un rôle majeur dans les réponses immunitaires. Elle contrôle les lymphocytes T régulateurs en chaperonnant GARP (Glycoprotéin A répétitive prédominant), récepteur d’ancrage du TGF-β, contribue au phénotype immunosuppresseur des macrophages M2 (Chaumonnot et al, CDDis 2021) et chaperonne le complément C3 (Joly et al, Oncogene 2017 ; Seignez et al, JCIi 2017; Chaumonnot et al, Cell Death & Dis 2021). L’inhibition de GRP94 par l’inhibiteur chimique PU-WS13 induit une diminution des macrophages de type M2 dans le microenvironnement tumoral, ainsi qu’une réduction de la croissance tumorale qui corrèle avec avec une augmentation des cellules CD8+. En situation de stress du RE induit par l’altération de l’homéostasie du calcium ou des conditions d’obésité, GRP94 induit un switch de polarisation M2-M1, favorise la sécrétion de cathepsine L et est co-sécrétée avec le complément C3 dans le milieu extracellulaire où elle pourrait faciliter son activation, ces deux effets étant pro-inflammatoires (Chaumonnot et al, Cell Death and Dis 2021 ; Wang et al, soumis).
Objectifs. 1-Valider GRP94 comme cible thérapeutique dans le cancer a) comprendre le rôle de GRP94 dans l’immunosuppression médiée par les macrophages M2 notamment son impact sur le TGFβ; b) développer en collaboration avec Pharm’Image des outils pour optimiser la détection in vivo de GRP94 et GARP par pharmaco-imagerie (tomographie par émission de positons couplée à l’imagerie par résonance magnétique – PET-MRI) ; c) cribler et évaluer des inhibiteurs de GRP94 pour leur capacité à inhiber son activité chaperonne et à réduire la fonction immunosuppressive des Tregs et des macrophages M2 ; d) vectoriser le ou les inhibiteurs finalement sélectionnés ainsi qu’un siRNA en utilisant des nanovecteurs lipidiques (avec notre Labex LipSTIC) pour optimiser la formulation et permettre un ciblage plus spécifique. 2- Étudier, dans un modèle murin d’addiction, l’interaction GRP94/complément C3/ cathepsine L et les conséquences (avec le Pr W Zhou, Ningbo University). 3- En collaboration avec le Pr M Narce (U1231 Equipe LIPNESS) étudier le rôle de GRP94 dans la modulation du complément C3 et de la cathepsine L lors du stress du RE induit par un régime obésogène.
- Frédéric Lirussi (PU-PH, HDR) Contact : mail
- Maeva Wendremaire (MCF, Assistant Professor)
- Tatiana Lopez (PhD-ATER)
- Oriane Duquet (Intern/resident in biology
- Elisabeth Bouysse (Tech)
Collaborations : C. Michiels, R. Maudinas (University Hospital of Dijon), T. Hadi (NYU Langone University), A. Schmitt (CGFL, Dijon), F. Neiers (CSGA, INRA, Dijon), S. Messaoudi (Laboratoire BioCIS UMR 8076, Paris), P. Couvreur (UMR CNRS 8612 Galien Institute), K. Pyrshev (University of Texas Health Science Center, Houston), Dr. JL Desseyn (Infinite – U1286 Inserm, Lille) .Financement : ANR JCJC, 2017-2021, AAP Plateforme 2021.
Rationnel. Nous avons récemment démontré que GroEL (HSP60 du procaryote) est sécrété par des cultures de Lactobacillus lorsqu’elles sont cultivées dans des biofilms (pour mimer la colonisation intestinale des probiotiques) et induit, dans les monocytes/macrophages, une réponse anti-inflammatoire en bloquant la libération de TNF-alpha ou IL-1-bêta (Dias et al, J Gastroenterol 2021). Nous avons également montré que le récepteur β3-adrénergique est exprimé et fonctionnel dans les macrophages et lymphocytes intestinaux humains. Sa stimulation conduit à des effets anti-inflammatoires et anti-oxydantes et est également capable d’interférer avec l’expression de différentes HSPs.
Objectifs.Étudier le rôle de HSP60 (GroEL) sécrété par des lactobacilles et du récepteur β3-AR sur l’homéostasie intestinale, via la régulation des macrophages/lymphocytes in vitro, ex vivo dans des cultures tissulaires et/ou 3D réalisées avec des cryptes intestinales isolées de biopsies coliques de patients (Dr. B. Paquette, service de chirurgie digestive, CHU de Besançon) et dans nos modèles murins de maladies inflammatoires chroniques de l’intestin (MICI) aiguës ou chroniques. Utiliser GroEL et/ou des agonistes de B3-AR dans la prise en charge des maladies inflammatoires de l’intestin. Tous nos agents pharmacologiques (β3-bloquants, β3-agonistes) testés étant hautement lipophiles, nous entendons utiliser notre technologie récemment brevetée qui utilise les lipoprotéines (HDL-dérivés) comme nanovecteurs (FR3051674-A1 ; WO2017207897-A1. Hadi et al, JCI Insight 2020).
- Gaetan Jego (PU, HDR) Contact : mail
- Carmen Garrido (DRCE Inserm) Contact :
- Jimena Abrey (Post-doc)
- Rim Belkaid (IE)
Financement :Projet financé par la compagnie Hastim
Rationnel. Le vaccin thérapeutique autologue dans le cancer permettra un traitement personnalisé et universel du cancer. Dans ce but, l’immunisation des patients cancéreux avec des complexes HSP-peptide dérivés de tumeurs autologues directement isolés de la biopsie tumorale était un concept d’immunothérapie personnalisée développé il y a plus de 20 ans (Srivastava et al, Nat Immunol 2000). Même s’il semblait sûr et a montré des résultats encourageants chez les patients atteints de cancer, les résultats obtenus étaient loin de ce qui était attendu. Comme nous avons appris l’importance de la vectorisation dans les stratégies vaccinales, ce concept de vaccination personnalisée est en cours d’actualisation. Hastim, société de biotechnologie française pionnière dans la recherche sur le vecteur de stimulation immunitaire a mis au point un support d’hydroxyapatite qui permet également une concentration HSP-dépendante des antigènes peptidiques tumoraux. Ces vaccins thérapeutiques autologues à base d’hydroxyapatite (APAVAC®) sont déjà utilisés en clinique vétérinaire (chiens et chevaux atteints d’un lymphome B) avec des résultats remarquables. Dans l’objectif final de tester ce vaccin personnalisé chez des patients (un essai clinique de phase I), nous devons d’abord utiliser des modèles précliniques de souris cancéreuses, pour explorer à la fois l’efficacité in vivo d’APAVAC®, ainsi que son mécanisme d’action.
Objectifs. Caractériser l’effet immunothérapeutique de ces vaccins à base d’hydroxyapatite en utilisant différents modèles expérimentaux de cancer du rongeur, y compris un modèle murin humanisé xénogreffé avec des tumeurs dérivées de patients. Identifier des marqueurs biologiques universels pour prédire la réponse à ce traitement personnalisé du cancer. Établir les bases pour lancer une étude d’essai clinique pilote de phase 1 dans le lymphome diffus à grandes cellules B non hodgkinien.
- Laurence DUBREZ (CRHC Inserm) Contact : mail
- Aymeric ZADOROZNYJ (PhD)
- Manon PACCAGNINI (PhD)

Les IAP (inhibitors of apoptosis) constituent une famille de protéines conservées au cours de l’évolution. Elles ont été découvertes chez le baculovirus pour leur capacité à bloquer la mort des cellules infectées (Gyrd-Hansen et al. Nat. Rev. 2010). Hormis une fonction anti-apoptotique, les IAP ont été impliquées dans la réponse immunitaire innée, la réponse inflammatoire, la prolifération cellulaire, la différenciation cellulaire et la motilité cellulaire. Le génome humain code 8 IAP dont cIAP1.
cIAP1 est une enzyme de la réaction d’ubiquitination (E3 ubiquitinase ligase). Elle catalyse la conjugaison de molécules ou de chaînes d’ubiquitines sur une protéine partenaire. Grâce à cette activité enzymatique, elle a la capacité de moduler la stabilité, l’activité et le réseau d’interaction d’une protéine partenaire. La plupart des partenaires identifiées sont des molécules de signalisation (Dumétier et al., Cells 2020). cIAP1 peut donc contrôler la mise en place et la durée d’activation des voies de signalisation intracellulaire. Elle va ainsi permettre aux cellules de s’adapter à un environnement changeant et de lutter contre des stresses intra- ou extracellulaires.
Nous avons montré que cIAP1 était exprimé aussi bien dans le noyau que dans le cytoplasme des cellules et nous avons identifié de nouvelles fonctions de signalisation cellulaire (Plenchette et al. Blood 2004, Didelot et al. CDD 2008, Dupoux et al., Blood 2009, Cartier et al. J. Biol. Chem. 2011, Marivin et al. Oncogene 2014, Glorian et al. CDDi 2017, Allègre et al. PlosONE 2018, Dumétier et al. Oncogene 2022, Tencer et al. Nat Struct Cell Biol in revision).
Notre projet de recherche a pour but (i) de déterminer les fonctions nucléaires de cIAP1, (ii) d’identifier de nouveaux partenaires, cibles d’ubiquitination et d’analyser son rôle dans la régulation de la signalisation cellulaire et (iii) de développer des inhibiteurs spécifiques et d’évaluer leur activité antitumorale et antifibrosante.
